 La direzione della divisione di una cellula determina la posizione delle due cellule figlie, contribuendo a definirne il destino verso la proliferazione o il differenziamento. Il controllo dell’orientamento della divisione cellulare è quindi fondamentale nei processi di sviluppo, nell’organizzazione dei tessuti e nella loro omeostasi. Uno studio pubblicato sulla rivista Current Biology dai gruppi di ricerca diretti da Giulia Guarguaglini dell’Istituto di biologia e patologia molecolari del Consiglio nazionale delle ricerche (Cnr-Ibpm) di Roma e Marina Mapelli dell’Istituto europeo di oncologia (IEO) di Milano, descrive e chiarisce il coinvolgimento in tale processo di due proteine, la chinasi Aurora-A e il suo attivatore TPX2, spesso presenti a livelli elevati nei tumori.
La direzione della divisione di una cellula determina la posizione delle due cellule figlie, contribuendo a definirne il destino verso la proliferazione o il differenziamento. Il controllo dell’orientamento della divisione cellulare è quindi fondamentale nei processi di sviluppo, nell’organizzazione dei tessuti e nella loro omeostasi. Uno studio pubblicato sulla rivista Current Biology dai gruppi di ricerca diretti da Giulia Guarguaglini dell’Istituto di biologia e patologia molecolari del Consiglio nazionale delle ricerche (Cnr-Ibpm) di Roma e Marina Mapelli dell’Istituto europeo di oncologia (IEO) di Milano, descrive e chiarisce il coinvolgimento in tale processo di due proteine, la chinasi Aurora-A e il suo attivatore TPX2, spesso presenti a livelli elevati nei tumori.
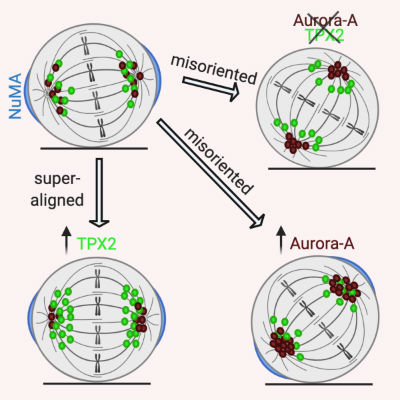
“L’orientamento della divisione cellulare dipende da come è posizionato – rispetto al tessuto – l’asse del fuso mitotico, la struttura deputata alla segregazione del materiale genetico nelle cellule figlie, ed è orchestrato da un complesso proteico che connette i due poli del fuso a due regioni opposte della membrana cellulare”, spiega Giulia Guarguaglini. “I nuovi risultati mostrano come Aurora-A e TPX2 cooperino in questo meccanismo e come regolino l’orientamento della divisione anche attraverso una via indipendente che coinvolge i microtubuli, principali costituenti del fuso. Sbilanciamenti nei livelli delle due proteine o nella loro interazione portano a variazioni di inclinazione dell’asse di divisione cellulare, che potrebbero alterare l’equilibrio tra proliferazione e differenziamento cellulare in un tessuto”.
I nuovi risultati della collaborazione tra i due gruppi di ricerca fanno seguito a quelli che nel 2016 avevano portato all’identificazione della chinasi Aurora-A come regolatore chiave di uno dei componenti del complesso di orientamento, la proteina NuMA. “Questo studio aggiunge un livello regolativo al controllo della divisione cellulare da parte dell’asse di segnalazione Aurora-A/TPX2, spesso alterato nei tumori e studiato come potenziale bersaglio in terapie antitumorali, e fornisce una nuova chiave per comprendere le funzioni pro-tumorigeniche di tale complesso molecolare”, prosegue Marina Mapelli. “Sbilanciamenti del corredo cromosomico dovuti ai ruoli già noti delle due proteine, se associati ad alterazioni nell’organizzazione tissutale dovute a difetti nell’orientamento della divisione cellulare, potrebbero infatti favorire l’insorgenza e propagazione del tumore. Poiché difetti nell’orientamento della divisione sono associati a patologie dello sviluppo o neurologiche, lo studio apre anche la strada all’esplorazione della funzione di queste due proteine in nuovi contesti patologici”.
Lo studio è realizzato con il sostegno di AIRC, Ministero della salute e Regione Lazio (nell’ambito dei progetti “Gruppi di ricerca” e “Torno subito”), hanno collaborato anche gruppi di ricerca dell’Università Sapienza di Roma e del Max Planck Institute of molecular physiology di Dortmund.
Figura: orientamento del fuso mitotico in una cellula normale o in presenza di livelli alterati di Aurora-A o TPX2. Da “Polverino et al., 2020, Current Biology”. Created with BioRender.com.
 EnnaVivi Magazine della provincia di Enna
EnnaVivi Magazine della provincia di Enna